Hukum Boyle
Robert
Boyle (1627‐1691) melakukan eksperimen untuk menyelidiki hubungan
kuantitatif antara tekanan dan volume gas. Percobaan ini dilakukan
dengan memasukkan sejumlah gas tertentu ke dalam sebuah wadah tertutup.
Sampai pendekatan yang cukup baik, Ia menemukan bahwa apabila suhu gas
dijaga konstan, maka ketika tekanan gas bertambah, volume gas berkurang.
Demikian juga sebaliknya ketika tekanan gas berkurang, volume gas
bertambah. Tekanan gas berbanding terbalik dengan volume gas. Hubungan
ini dikenal dengan julukan Hukum Boyle. Secara matematis :

Hukum Boyle juga bisa ditulis :
PV = konstan → persamaan 1
P1 V1 = P2 V2 → persamaan 2
 Arti
dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas
berubah maka volume (V) gas juga berubah sehingga hasil kali antara
tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume
gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume
gas bertambah, sehingga hasil kali antara tekanan dan volume selalu
konstan.
Arti
dari persamaan 1 adalah pada suhu (T) konstan, apabila tekanan (P) gas
berubah maka volume (V) gas juga berubah sehingga hasil kali antara
tekanan dan volume selalu konstan. Apabila tekanan gas bertambah, volume
gas berkurang atau sebaliknya jika tekanan gas berkurang maka volume
gas bertambah, sehingga hasil kali antara tekanan dan volume selalu
konstan.
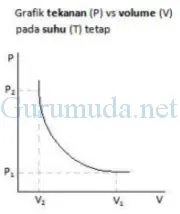
Grafik
yang menyatakan hubungan antara volume dan tekanan tampak seperti pada
gambar di bawah. Berdasarkan hasil percobaannya, Robert Boyle menemukan
bahwa volume gas mengalami perubahan secara tidak teratur sehingga garis
pada grafik kelihatan melengkung. Tekanan yang diganbarkan pada grafik
merupakan adalah tekanan absolut, bukan tekanan ukur.
Hukum Charles
Seratus
tahun setelah Robert Boyle menemukan hubungan antara volume dan
tekanan, ilmuwan berkebangsaan Perancis yang bernama Jacques Charles
(1746‐1823) menyelidiki hubungan antara suhu dan volume gas. Berdasarkan
hasil percobaannya, Ia menemukan apabila tekanan gas selalu konstan,
maka ketika suhu gas bertambah, volume gas juga bertambah. Sebaliknya
ketika suhu gas berkurang, volume gas juga berkurang.
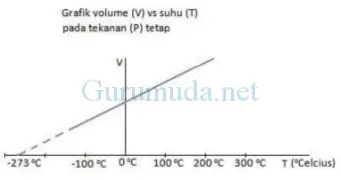
Perubahan
volume gas akibat adanya perubahan suhu, terjadi secara teratur
sehingga garis pada grafik ini tampak lurus. Apabila garis pada grafik
digambarkan sampai suhu yang lebih rendah maka garis akan memotong sumbu
di sekitar ‐273 oC.
Berdasarkan
banyak percobaan yang pernah dilakukan, ditemukan bahwa walaupun
besarnya perubahan volume setiap gas berbeda‐beda, tetapi ketika garis
pada grafik V‐T digambarkan sampai suhu yang lebih rendah maka garis
selalu memotong sumbu di sekitar -273 oC. Kita bisa mengatakan bahwa seandainya gas didinginkan sampai ‐273 oC maka volume gas = 0. Apabila gas didinginkan lagi hingga suhunya berada di bawah ‐273 oC maka volume gas akan bernilai negatif, sesuatu yang tidak mungkin.
Jadi ‐273 oC merupakan suhu terendah yang bisa dicapai. Karena garis memotong sumbu di sekitar ‐273 oC maka sesuai dengan kesepakatan bersama, di tetapkan bahwa suhu terendah yang bisa dicapai adalah ‐273,15 oC. ‐273,15 oC
disebut suhu nol mutlak dan dijadikan acuan skala mutlak alias skala
Kelvin. Kelvin adalah nama Lord Kelvin (1824‐1907), fisikawan Inggris.
Pada skala ini, suhu dinyatakan dalam Kelvin (K), bukan derajat Kelvin (oK). Jarak antara derajat sama seperti pada skala celcius. 0 K = ‐273,15 oC dan 273,15 K = 0 oC.
 Suhu
dalam skala Celcius dapat diubah menjadi skala Kelvin dengan
menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala
Celcius dengan mengurangi 273,15. Secara matematis :
Suhu
dalam skala Celcius dapat diubah menjadi skala Kelvin dengan
menambahkan 273,15, suhu dalam skala Kelvin bisa diubah menjadi skala
Celcius dengan mengurangi 273,15. Secara matematis :
T (K) = T (oC) + 273,15
T (oC) = T (K) ‐ 273,15
Keterangan :
T = Temperatur alias suhu
K = Kelvin
C = Celcius
Jika suhu dinyatakan dalam skala Kelvin maka grafik di atas akan tampak seperti gambar di bawah.
Berdasarkan
grafik ini bisa disimpulkan bahwa pada tekanan tetap, volume gas selalu
berbanding lurus dengan suhu mutlak gas. Apabila suhu mutlak gas
bertambah maka volume gas juga bertambah, sebaliknya apabila suhu mutlak
gas berkurang maka volume gas juga berkurang. Hubungan ini dikenal
dengan julukan hukum Charles. Secara matematis ditulis sebagai berikut :
Volume ∝ Suhu → Tekanan konstan
V ∝ T → P konstan
Hukum Charles juga bisa ditulis seperti ini :

Arti
dari persamaan 1 adalah pada tekanan (P) konstan, apabila suhu mutlak
(T) gas berubah maka volume (V) gas juga berubah sehingga hasil
perbandingan antara suhu mutlak dan volume selalu konstan. Jika suhu
mutlak gas bertambah, maka volume gas juga bertambah atau sebaliknya
jika suhu mutlak gas berkurang maka volume gas juga berkurang, sehingga
hasil perbandingan antara suhu dan volume selalu konstan. Yang
dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan dalam
skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah
terlebih dahulu ke dalam skala Kelvin.
Hukum Gay‐Lussac
Joseph
Gay‐Lussac (1778‐1850) melakukan percobaan dan menemukan bahwa apabila
volume gas diatur konstan, ketika tekanan gas bertambah, suhu mutlak gas
pun bertambah. Demikian juga sebaliknya ketika tekanan gas berkurang,
suhu mutlak gas pun berkurang. Pada volume konstan, tekanan gas
berbanding lurus dengan suhu mutlak gas. Hubungan ini disebut Hukum
Gay‐Lussac. Secara matematis :
Tekanan ∝ Suhu → Volume konstan
P ∝ T → V konstan
Hukum Gay‐Lussac juga bisa ditulis seperti ini :

Arti
dari persamaan 1 adalah pada volume (V) konstan, apabila tekanan (P)
gas berubah maka suhu mutlak (T) gas juga berubah sehingga hasil
perbandingan antara tekanan dan suhu mutlak konstan. Dengan kata lain,
jika tekanan gas bertambah, maka suhu mutlak gas juga bertambah atau
sebaliknya jika tekanan gas berkurang maka suhu mutlak gas juga
berkurang, sehingga hasil perbandingan antara tekanan dan suhu selalu
konstan.
Yang
dimaksudkan dengan suhu mutlak gas adalah suhu gas yang dinyatakan
dalam skala Kelvin. Apabila suhu masih dalam skala Celcius, maka ubah
terlebih dahulu ke dalam skala Kelvin.
Perlu
diketahui bahwa hukum Boyle, hukum Charles dan hukum Gay‐Lussac
memberikan hasil yang akurat apabila tekanan dan massa jenis gas tidak
terlalu besar. Di samping itu, ketiga hukum tersebut juga hanya berlaku
untuk gas yang suhunya tidak mendekati titik didih.
Berdasarkan
kenyataan ini, bisa disimpulkan bahwa hukum Boyle, hukum Charles dan
hukum Gay‐Lussac tidak bisa diterapkan untuk semua kondisi gas. Karena
tidak bisa berlaku untuk semua kondisi gas ril, maka kita memerlukan
konsep Gas Ideal alias gas sempurna. Gas ideal ini tidak ada dalam
kehidupan sehari‐hari. Gas ideal hanya sebuah model ideal saja, mirip
seperti konsep benda tegar dan fluida ideal. Jadi kita menganggap ketiga
hukum gas di atas berlaku dalam semua kondisi gas ideal.
Dalam
menyelesaikan soal‐soal hukum gas, suhu harus dinyatakan dalam skala
Kelvin. Apabila tekanan gas masih berupa tekanan ukur, ubah terlebih
dahulu menjadi tekanan absolut. Tekanan absolut = tekanan atmosfir +
tekanan ukur.